Virus snyder og afvæbner bakteriers immunforsvar med RNA-”lokkeduer”
Bakterieangribende virus, kendt som fager, bruger små RNA-stykker til at afvæbne bakteriers immunforsvar. Det har forskere ved Københavns Universitet, som de første dokumenteret. De hæmmende RNA-stykker, navngivet ’Racrs,’ kan blive et betydeligt gennembrud i bestræbelserne på at kontrollere genteknologier og forbedre fagterapi som alternativ til antibiotika.
Mikrobernes verden er en slagmark, hvor mikroskopiske organismer konstant kæmper om ressourcer, overlevelse og reproduktion. Bakterier bliver angrebet af fager og andre genetiske parasitter, der kun kan formere sig ved at invadere bakterierne.
CRISPR-Cas-systemer er en af de primære forsvarsmekanismer, som bakterier bruger til at beskytte sig mod fagerne. CRISPR-Cas gemmer små stykker af indtrængende fagers DNA, som de senere kan bruge til at genkende fagerne, for dernæst at klippe dem i stykker, som en ’genetisk saks’.
I en ny forskningsartikel har forskere fra Københavns Universitet, i samarbejde med kolleger fra University of Otago i New Zealand, identificeret et modtræk i det mikroskopiske våbenkapløb, der måske kan åbne nye døre for lægevidenskaben - potentielt i form af mere sikre CRISPR-Cas-behandlinger og forbedrede muligheder for fagterapi.
Brugen af disse molekylære CRISPR-Cas-sakse som et genteknologisk værktøj førte til Nobelprisen i kemi i 2020. Samtidigt er der de senere år kommet stor opmærksomhed på fagers potentielle anvendelse til behandling af bakterieinfektioner, bl.a på grund af en stigende antibiotikaresistens.
Fakta: Fager og fagterapi
Bakteriofager, eller bare fager, er virus, der angriber og invaderer bakterier, for at bruge deres reproduktionssystem til at kopiere sig selv. Fager kan ikke angribe menneskelige celler.
Fagterapi bruger opdyrkede fager i behandlinger til at bekæmpe bakterieinfektioner, og udgør et alternativ til antibiotika.
Udviklingen af antibiotika skubbede i midten af 1900-tallet behandlingsformen i baggrunden, men en voksende antibiotika-resistenskrise har de senere år fået fagterapi tilbage i fokus
En af udfordringerne ved fagterapi er dog at bakterier relativt hurtigt kan udvikle immunitet over for de anvendte fager. Her kan den nye forskning komme til at spille en rolle.
Lokkeduer i forklædning
"Vi har beskrevet en fascinerende ny strategi, som fager bruger til at deaktivere bakteriernes CRISPR-Cas immunrespons," siger lektor Rafael Pinilla-Redondo fra Biologisk Institut, der ledte forskningsindsatsen i København.
I en tidligere undersøgelse havde forskere identificeret sekvenser i fagers genomer, der mindede om dele af en CRISPR immun-hukommelse. Men deres funktion var forblevet en gåde. Nu har forskerne fra København og Otago dokumenteret, at fager kan bruge disse små RNA-stykker til at afvæbne bakteriernes CRISPR-Cas-forsvarsmekanismer.
"Vi kan se, at fager bruger disse små RNA-stykker, der efterligner dele af CRISPR-Cas som en slags lokkeduer for immunsystemets komponenter. Det svindelnummer gør det muligt for fager at inficere bakterierne," forklarer ph.d. Sarah Camara fra Biologisk Institut, der er førsteforfatter til artiklen sammen med ph.d. David Mayo-Muñoz fra University of Otago.
Forskerne har fundet ud af, at disse molekylære lokkeduer binder sig til vigtige komponenter i CRISPR-Cas-systemet. Det fører til, at der dannes dysfunktionelle immunkomplekser, som mangler nogle afgørende proteiner, for at kunne bekæmpe infektionen af fager.
”Strategien ser ud til at være udbredt, hvilket er af stor interesse for grundforskningen, og samtidigt et betydeligt fremskridt for det målrettede CRISPR-Cas-felt," tilføjer professor Søren J. Sørensen fra Biologisk Institut, der er medforfatter og vejleder på den nye forskningsartikel.
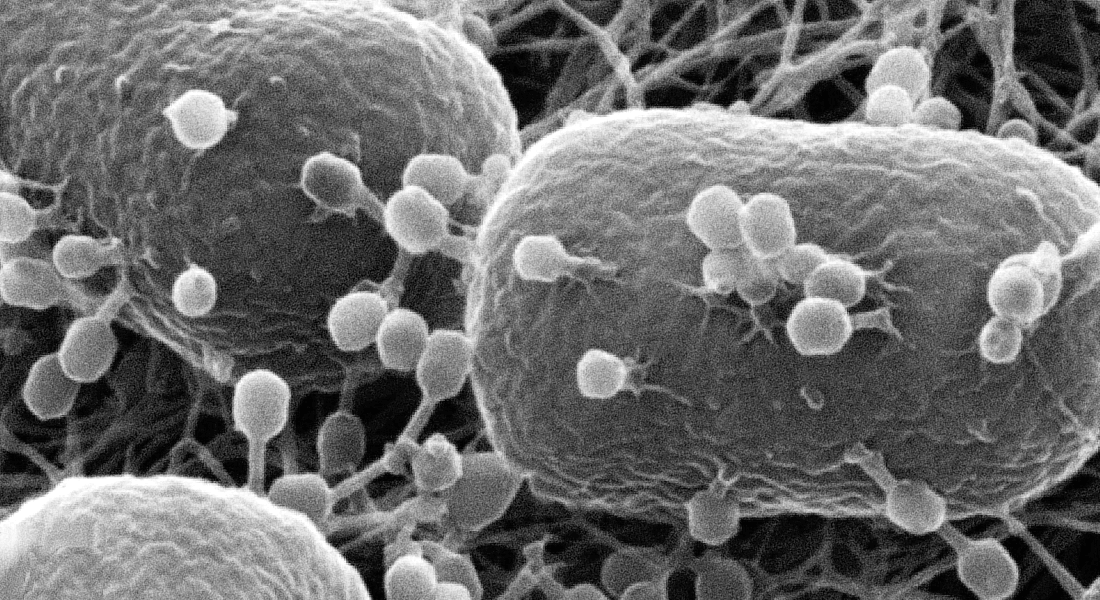
Kan styrke alternativet til antibiotika
Opdagelsen af Racrs kan blive et gennembrud for fagterapi, ved at effektivisere denne alternative måde at behandle bakterielle infektioner på.
I dag er antibiotikaresistens blevet en af de mest betydelige trusler mod den globale sundhed. Farlige infektioner, forårsaget af superbakterier, dræber hvert år mere end en million mennesker på verdensplan. Og det tal forventes at tidoble inden 2050.
Eksperter taler om at antibiotikas æra nærmer sig sin afslutning, og dét er baggrunden for at fagterapi i dag er ved at gøre comeback. Opdagelsen af Racrs kan ende med at spille en vigtig rolle i at forbedre sådanne terapier i fremtiden.
En udfordring for fagterapi er nemlig, at bakterier kan udvikle immunitet over for fager ved hjælp af CRISPR-Cas-systemerne. Det er her Racrs kommer ind i billedet. Det åbner muligheden for, at forskere vil kunne designe fager, der også bærer CRISPR-Cas-hæmmende Racrs, og dermed kan blokere bakteriernes immunforsvar og dræbe de sygdomsfremkaldende bakterier.
"Der skal findes alternativer til antibiotika, og det bliver stadig mere tydeligt, at fagterapi kan blive effektiv, samtidig med at den er meget specifik," forklarer professor Søren Sørensen.
"Mens penicillin har en bred virkning og dræber en hel række bakterier, herunder vores tarmbakterier - hvilket er langt fra ideelt - er fager meget mere specifikke med hensyn til de bakterier, de angriber," tilføjer han.
Mere sikre CRISPR-behandlinger
Fakta: Sådan virker Racrs
Bakterier bruger CRISPR-Cas som et immunforsvar mod fager. Små stykker fag-DNA opbevares som et ’forbryderalbum’ i bakteriens ’CRISPR-hukommelse’.
Omdannet til RNA-stykker, guider de protein-sakse (Cas) til matchende sekvenser i indtrængende fagers genomer og klipper dem i stykker.
Racrs er små RNA-stykker som fagerne udskiller når de inficerer bakterieceller. Disse RNA-stykker fungerer som ’lokkeduer’.
Ved at efterligne dele af RNA-guiderne interagerer lokkeduerne med Cas-proteiner og danner som resultat dysfunktionelle immunitetskomplekser - sammensætninger, der mangler afgørende komponenter og derfor ikke fungerer.
En anden lovende anvendelse for Racrs, drejer sig om at kontrollere CRISPR-Cas-genteknologier, og dermed gøre behandlinger med dem mere sikre og præcise. Disse fremstormende behandlingsformer kan bruges til at lave direkte ændringer i DNA og bliver stadig mere populære inden for bioteknologi og med store potentialer inden for genterapi.
Disse teknologier er imidlertid stadig begrænsede af udfordringer med at kontrollere CRISPR-Cas, når de først er blevet indført i celler. Derfor er der stærk efterspørgsel på måder at styre CRISPR-Cas-værktøjskassen på.
"Racrs kan potentielt bruges til at skabe mere specifikke og kontrollerede behandlinger, fordi anti-CRISPR'er giver os mulighed for at styre aktiviteten af CRISPR-Cas," siger lektor Rafael Pinilla-Redondo.
Proteiner i en høstak og indekseret RNA
Identifikationen af anti-CRISPR-proteiner har det sidste årti tiltrukket stor opmærksomhed fra forskere og betydelige forskningsmidler på grund af bioteknologiske forhåbninger. Men at finde anti-CRISPR-proteiner har vist sig at være vanskeligt.
"Dette er ikke tilfældet med RNA-baserede Racrs. Netop fordi disse anti-CRISPR'er efterligner dele af de bakterielle CRISPRs gemte DNA-stykker, gør det opgaven med at identificere dem enklere, og øger muligheder for at designe løsninger med dem," forklarer Rafael Pinilla-Redondo.
Om studiet: Forskernes bag
Følgende forskere har bidraget til forskningsstudiet:
Sarah Camara-Wilpert, Jakob Russel, Jonas S. Madsen, Søren J. Sørensen og Rafael Pinilla-Redondo fra Biologisk Institut ved Københavns Universitet
David Mayo-Muñoz, Robert D. Fagerlund og Peter C. Fineran fra Otago University, New Zealand:
Kontakt
Sarah Camara-Wilpert
Ph.d.
Biologisk Institut
Købenahavns Universitet
Rafael Pinilla Redondo
Adjunkt
Biologisk Institut
Københavns Universitet
rafael.pinilla@bio.ku.dk
35 32 80 49
Søren Johannes Sørensen
Professor
Biologisk Institut
Københavns Universitet
sjs@bio.ku.dk
51 82 70 07
Kristian Bjørn-Hansen
Journalist og pressekontakt
Det Natur- og Biovidenskabelige Fakultet
Københavns Universitet
kbh@science.ku.dk
93 51 60 02
