Nybrud i CRISPR-forskning skal gøre det muligt at klippe mere effektivt og sikkert i menneskers gener
CRISPR kan ændre vores DNA og har et gigantisk potentiale indenfor blandt andet sygdomsbekæmpelse. Ny forskning fra Københavns Universitet kan være med til at sikre, at CRISPR ikke klipper i de forkerte gener.

For ti år skete der et nybrud inden for moderne biologi.
En amerikansk forsker opdagede, at man ved at manipulere med et protein kaldet Cas9 kunne udvikle gen-teknologi, der er en science fiction-film værdig.
Teknologien hedder CRISPR, og gør det muligt at omskrive selve livets kode.
CRISPR er nemlig en slags molekylær gensaks, der kan klippe i DNA hos både mennesker, dyr, planter, bakterier og virus.
Potentialet er gigantisk og tæller alt fra at slette arvelige sygdomme til at skabe afgrøder, der kan modstå klimaforandringer.
Men som med al anden ny teknologi er der også med CRISPR fødselsvanskeligheder. En af de største udfordringer for teknologien er at gøre den så effektiv som muligt, samt at sikre at saksen kun klipper lige der, hvor vi ønsker.
”Vi har beskrevet nye mekanismer, for hvordan CRISPR virker”
To nye studier fra Københavns Universitet, lavet i samarbejde med blandt andet forskere fra Århus Universitet, kan nu gøre os klogere på, hvordan vi løser lige præcis de vanskeligheder.
”Vi har beskrevet nye mekanismer, for hvordan CRISPR virker,” siger professor i bioinformatik Jan Gorodkin fra Institut for Veterinær- og Husdyrvidenskab og uddyber:
”Nu kan vi blandt andet forklare, hvorfor nogle ’off-targets’ (når gensaksen ikke rammer det, der var tiltænkt red.) kan være mere effektive end ’on-targets’ (når gensaksen rammer det tiltænkte sted). Vi har også fundet ud af, hvordan forskellige DNA-sekvenser omkring målet kan påvirke, hvor effektivt Cas9-proteinet kløver DNA'et. Det kan forhåbentlig bane vejen for, at CRISPR kan bruges mere sikkert og effektivt."
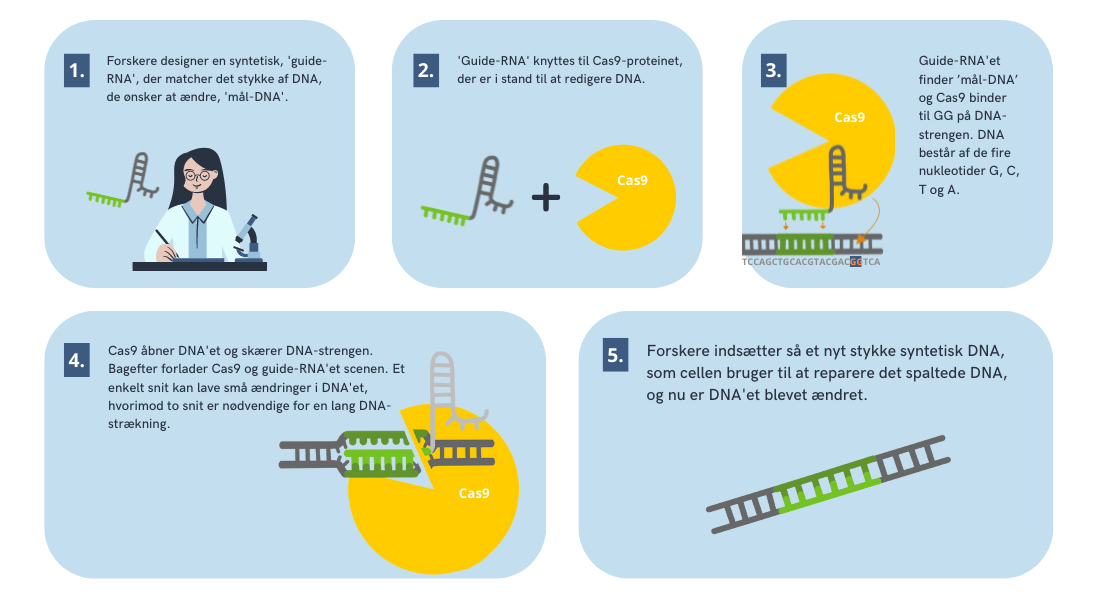
Men hvordan fungerer CRISPR egentlig? Først designer en forsker et stykke RNA, kaldet ”guide-RNA”. Det kobles på proteinet Cas9, der kan kløve DNA. Guide-RNA fungerer som en udkigspost, der kan lokalisere det sted, hvor der skal klippes. Når guide-RNA har fundet det rette sted, så klipper Cas9 i DNA-strengen. Når det er gjort, kan forskeren sætte et hvilket som helst stykke DNA ind på den plads, der nu er fri.
DNA-strenge er lange, så der er mange potentielle steder, Cas9 og guide-RNA kan ramme. Rammer Cas9 og guide-RNA’et det sted, som forskeren gerne vil ramme, så kalder man det ’on-target’, men rammer man ved en fejl et andet sted, så kaldes det ’off-target’.
I dag bruges CRISPR mest til at undersøge gener og medicin i et laboratorie. Det er altså endnu ikke udbredt som medicin til mennesker. Men perspektiverne er på sigt, at CRISPR kan være med til i første omgang at behandle nogle genetiske sygdomme.
Mysterium om effektive ’off-targets’ er nu løst
I det ene af de to ny studier har forskerne undersøgt, hvordan guide-RNA’et kan binde på den mest optimale måde, så kløvningen af DNA’et bliver så effektiv som muligt. For er kløvningen ikke effektiv nok, så er det ikke muligt at redigere i DNA’et.
”Vi ved allerede, at hvis bindingen mellem guide-RNA og DNA er for svag, så virker CRISPR ikke så godt. Men nu har vi fundet ud af, at det også er et problem, hvis den binder for stærkt,” siger professor Jan Gorodkin og fortsætter:
”I begge tilfælde resulterer det faktisk i en for svag og ineffektiv gensaks.”
I stedet er der et optimalt interval af bindings-energi mellem guide-RNA og DNA, som altså hverken skal være for stærk eller for svag. Rammer man det bedste niveau af bindings-energi, får man den optimale skarphed på saksen.
Vi har altså opdaget langt flere off-targets end med de gængse metoder
”Meget interessant, så forklarer det her, også hvorfor nogle off-targets, kan have stærkere CRISPR aktivitet end deres on-targets, det vil sige, at saksen klipper skarpere på off-target end on-target,” forklarer Jan Gorodkin. Han tilføjer:
”Forklaringen er nemlig, at de on-targets, der er for stærke, ikke er inden for det rette bindingsenergi-interval. Men hvis man trækker noget energi fra de her stærke bindinger, så kan man skubbe energien tilbage i det optimale interval, og dermed få kraftigere effekt, og dermed en stærkere effekt for off-targets”.
Studiet afdækker også, hvad der er Cas9-proteinets optimale placering for at skabe den mest effektive kløvning.
Inden Cas9 kan kløve DNA, så skal proteinet binde til et bestemt punkt på DNA-strengen. DNA er opbygget af fire forskellige nukleotider; A, C, G og T. Cas9 kan kun binde til et punkt på DNA-kæden, hvor der er to G-nukleotider efter hinanden.
Men som noget helt nyt, har forskerne fundet ud af, hvordan Cas9 påvirkes, hvis der er mange G-nukleotider lige efter hinanden. Altså en situation, hvor det er sværere at ramme præcist, fordi Cas9 kan binde mange steder.
”Når vi har adskillige G’er ’opstrøms’ – altså før der hvor Cas9 binder, så sker kløvningen med en højere effektivitet. Men når der er adskillige G’er ’nedstrøms’ – altså efter der hvor Cas9 binder, så er der lavere effektivitet,” siger postdoc Giulia Corsi.
Med den nye viden om, hvordan CRISPR fungerer, håber Giulia Corsi, at der i fremtiden skal bruges færre ressourcer til at gennemskue, hvor den optimale placering for Cas9 er. Dette er også med til at minimere eventuelle bi-virkninger.
”Vi vil gerne kunne forudsige kløvningsaktiviteten, forbedre mål-redigeringen uden off-targets, da de komplicerer udviklingen af medicin, og så kan bidrage til bi-effekter, hvis man ved en fejl klipper det forkerte gen,” siger Giulia Corsi.
Off-targets kan være skadelige – og de er understuderet
I det andet studie har forskerne også fokuseret på off-targets. Her har forskerne udviklet en metode til at måle effektiviteten af off-targets.
Normalt afprøver man CRISPR-eksperimenter ved, at man udvælger et mindre antal computerforudsagte off-targets som man vil teste. Men med den nye teknologi vil man være i stand til at teste for et meget større antal off-targets, hvilket forskerne forventer vil resultere i en hurtigere udvikling af medicinsk behandling med færre bi-effekter.
Jeg vil hævde - og nogle kan være uenige - at off-targets er ekstremt underforsket
Med den nye metode har forskerne undersøgt 8000 potentielle off-targets i 110 CRISPR guide RNA’er, der er ved at blive udviklet til medicin til mennesker. Forskerne fandt så ud af, at 10 procent af de 8000 potentielle off-targets faktisk var off-targets.
”Vi har altså opdaget langt flere off-targets end med de gængse metoder,” forklarer Jan Gorodkin.
Tilmed ligger 37 af disse off-targets i kræft-relaterede gener. Det betyder, at der er større risiko for at udvikling af medicin bliver sværere eller slet ikke lykkedes. Og så kan det potentielt lede til kræft som bi-effekt.
"Forskere skal være i stand til at identificere sådanne off-targets og udvælge andre guide-RNA'er, som ikke har disse eller andre kritiske off-targets," siger Jan Gorodkin.
Stort behov for mere forskning i off-targets
Ifølge Jan Gorodkin viser studiets resultater, at der er et stort behov for mere forskning i off-targets.
"Jeg vil hævde - og nogle kan være uenige - at off-targets er ekstremt underforsket. Mit indtryk er, at eksisterende studier om genredigering ofte mangler de komplette værktøjer og analyser, der kræves for at vise, at der ikke er nogen off-target-effekter i deres studier,” siger han.
Den nye metode, vil ifølge Jan Gorodkin, have stor betydning for fremtidens undersøgelser for off-targets.
”I de seneste 10 år har vi taget et stort skridt i retning af at kunne redigere genomet. Nu er vi i gang med at gøre vores metoder mere sikre og effektive. Sidstnævnte understøtter også den grønne omstilling, da genom-modifikationer, for eksempel af celler, der bruges i produktionen, kan føre til en mere omkostningseffektiv udnyttelse af ressourcerne,” slutter Jan Gorodkin.
De to studier er lavet i tæt samarbejde med lektor Yonglun Luo’s forskerteam fra Aarhus Universitet. Studierne “CRISPR/Cas9 gRNA activity depends on free energy changes and on the target PAM context” og “Massively targeted evaluation of therapeutic CRISPR off-targets in cells” kan begge læses I Nature Communications.
Forskernes arbejde er blandt andet støtte af Danmarks Frie Forskningsfond, Innovationsfonden og Novo Nordisk Fonden.
Kontakt
Professor Jan Gorodkin
gorodkin@sund.ku.dk
+45 23 37 56 67
Postdoc Giulia Corsi
giulia.corsi@sund.ku.dk
Journalist og pressekonsulent Liva Polack
liva.polack@sund.ku.dk
+45 35 32 54 64
